Dans les maladies inflammatoires de l’intestin (MII), l’inflammation de l’intestin provoque une ruée des neutrophiles vers la zone enflammée pour agir. Dans cet environnement enflammé et en raison de la perturbation de la barrière intestinale et de sa perméabilité accrue, les neutrophiles infiltrent la muqueuse intestinale pour défendre l’organisme contre l’entrée de bactéries provenant de l’intérieur de l’intestin, et se « suicident » dans un processus connu sous le nom de Netosis, en formant des NETs, des structures en forme de réseau, dont la fonction est de détruire autant de bactéries « intruses » que possible, en libérant tout le contenu intracellulaire à l’extérieur. Un pourcentage très élevé du cytoplasme des neutrophiles est constitué de calprotectine, une protéine très résistante à la dégradation bactérienne et stable à température ambiante pendant des jours. Cette protéine passe dans la lumière de l’intestin (la barrière intestinale ayant perdu son intégrité) et est éliminée de l’organisme par les fèces, d’où son nom de calprotectine fécale (CF). Ainsi, en mesurant les niveaux de calprotectine dans les fèces, il est possible de déterminer par sa concentration si le patient est en poussée active ou non, et même la sévérité de la maladie.
Auteur/autrice : Adacyte
Actualités
La calprotectine fécale (CF) – qu’est-ce que c’est et quel rôle joue-t-elle dans les maladies inflammatoires de l’intestin ?
30 avril 2024
Pathologies

La mesure de la FC est très courante dans le diagnostic des MICI, afin de déterminer et d’évaluer l’état et la gravité de la maladie. En outre, il s’agit d’un biomarqueur qui permet une analyse non invasive des changements dans l’intestin d’un patient sur une longue période.
Comment se déroule un test de calprotectine fécale et quel est le meilleur moment pour le réaliser ?
La mesure de cette protéine se faisant par les selles, il est nécessaire de prélever un échantillon de selles du patient et de l’analyser. Les recommandations du GETECCU pour le prélèvement de l’échantillon sont les suivantes :
Il est recommandé de prélever une petite quantité de selles (environ 3 à 5 g) et de la déposer dans un récipient de collecte qui est généralement distribué au centre demandeur. Ce récipient ne nécessite aucun traitement spécifique. L’échantillon peut être prélevé dans n’importe quelle partie des selles, car il a été démontré que la FK se répartit de manière homogène et à tout moment de l’évolution de la maladie.
Par mesure de précaution et pour obtenir un résultat fiable, une diminution marquée des taux de FC a été observée lors de la préparation à la coloscopie. Par conséquent, si le patient doit subir une coloscopie, il faut veiller à prélever l’échantillon avant de commencer le nettoyage du côlon ou plusieurs jours après le test.
Que signifie une élévation de la calprotectine fécale ?
Lorsque la CF est élevée en cas de maladie inflammatoire de l’intestin, cela signifie qu’il y a une inflammation de l’intestin. Des taux élevés indiquent généralement des infections bactériennes, des infections parasitaires, un cancer colorectal ou certaines maladies qui provoquent une inflammation de l’intestin, telles que la colite ulcéreuse (CU) et la maladie de Crohn (CD).
Dans le cas de la RCH et de la MC, son élévation peut signifier que la maladie est active et peut provoquer des symptômes tels que des douleurs abdominales, des diarrhées ou des saignements, car le système immunitaire lutte pour réduire l’inflammation dans l’intestin.
Maintenant que vous savez ce qu’est la calprotectine fécale, le plus important est de faire confiance à votre médecin, de suivre le traitement prescrit et de lui communiquer vos symptômes afin qu’il puisse envisager la meilleure stratégie de prise en charge de votre maladie et effectuer les tests nécessaires à tout moment.
Actualités
Coloscopie et iléoscopie : des examens indispensables pour diagnostiquer les MICI
5 mai 2023
Pathologies

Diarrhée, douleurs abdominales, sang dans les selles, anémie, fatigue, fièvre, perte de poids. Autant de signes pouvant attirer l’attention sur un trouble digestif. Lorsqu’il soupçonne un patient de souffrir d’une maladie inflammatoire chronique de l’intestin (MICI), comme la rectocolite hémorragique ou la maladie de Crohn, le professionnel de santé a besoin d’outils de diagnostic fiables afin de confirmer ces pathologies et d’exclure d’autres troubles dont la symptomatologie est similaire
Outre les analyses de sang et de matières fécales, ainsi que les examens radiologiques, les examens endoscopiques sont une technique fondamentale et indispensable pour le diagnostic des MICI.
Ces examens endoscopiques sont notamment l’entéroscopie, l’échographie endo-anale, l’endoscopie par vidéo-capsule, l’endoscopie digestive haute ou gastroscopie et l’endoscopie digestive basse ou iléocoloscopie. Nous expliquerons ci-dessous en quoi consiste cette dernière technique, qui comprend à la fois une coloscopie et une iléoscopie.
L’iléocoloscopie comme outil de diagnostic
L’iléocoloscopie est l’un des examens endoscopiques les plus couramment pratiqués pour diagnostiquer les MICI. C’est grâce à elle que les professionnels de santé peuvent directement visualiser la muqueuse intestinale, aussi bien au niveau du côlon (coloscopie) qu’à l’extrémité de l’intestin grêle ou section terminale de l’iléon (iléoscopie).
Il est ainsi possible de savoir si le patient souffre de la maladie de Crohn ou de rectocolite hémorragique car les caractéristiques endoscopiques de ces maladies sont uniques et très différentes. De plus, ces examens permettent de choisir l’option thérapeutique la plus appropriée et de décider si une intervention chirurgicale est nécessaire en visualisant l’étendue et la gravité des dommages, ainsi que leur emplacement exact dans le côlon et la section terminale de l’iléon. Dans le cas de la maladie de Crohn, il est fréquent que l’iléon soit atteint, d’où l’intérêt d’effectuer une iléoscopie en même temps qu’une coloscopie dans ces cas précis.
D’autre part, ces techniques sont des outils efficaces pour exclure les effets causés par les médicaments, tels que les anti-inflammatoires, ou d’autres types de pathologies ayant des symptômes similaires comme la colite infectieuse. Il est également possible de réaliser des biopsies (prélèvements de tissus) lors de l’exploration afin d’effectuer un examen anatomopathologique ou des actes thérapeutiques, tels qu’une polypectomie (ablation de polypes) ou une dilatation des sténoses (réductions du diamètre intérieur de l’intestin).
Suivi à long terme des patients atteints de MICI
Le suivi de l’évolution de la maladie inflammatoire sur le long terme est essentiel pour anticiper les poussées, évaluer l’efficacité du traitement que suit le patient et le modifier si nécessaire. Et dans ce cas, l’iléocoloscopie est très utile car elle permet de visualiser l’étendue et l’évolution de l’atteinte du côlon et de l’extrémité de l’intestin grêle ou section terminale de l’iléon.
Lorsque le patient présente une MICI de longue date, il est plus susceptible de développer un cancer colorectal que la population générale. Le risque est plus ou moins important selon la durée et l’étendue de la maladie. Par conséquent, la surveillance endoscopique par iléocoloscopie peut être un outil efficace pour détecter les lésions précancéreuses et agir le plus tôt possible, réduisant ainsi la mortalité associée au cancer colorectal.
L’iléoscopie est également très utile après une intervention chirurgicale. Elle est d’ailleurs considérée comme une référence absolue, car elle permet d’établir l’apparition d’une récidive morphologique et sa sévérité, directement liée à l’évolution clinique à long terme1.
Comment préparer le patient à l’examen ?
À l’instar de toute procédure endoscopique, la coloscopie et l’iléoscopie exigent une préparation du patient avant l’examen. Ces préparatifs sont l’adoption d’un régime alimentaire particulier et, parfois, la suppression de certains médicaments. Dans ce dernier cas, le professionnel de santé lui indiquera comment procéder avec ces médicaments afin d’éviter les complications qui pourraient rendre l’exploration difficile.
Concernant le régime alimentaire préalable2 que le patient doit suivre, un régime sans résidus devra être entamé deux jours avant l’examen. Seront interdits les fromages gras, les produits laitiers au lait entier, les poissons bleus, les viandes grasses, les saucisses, les produits à base de céréales complètes, les fruits, les légumes, les légumineuses, le chocolat, les pâtisseries et les fruits secs.
En revanche, les aliments autorisés lors de ce régime spécial sont : le lait écrémé et le yaourt nature, les fromages frais, les fromages à pâte dure et un peu de beurre ; le pain blanc ou grillé et les biscuits aux céréales non complètes ; le bouillon sans les légumes ; le riz et les pâtes à base de céréales non complètes ; les pommes de terre en purée ou bouillies, sans la peau ; les viandes et poissons blancs grillés ou cuits ; le coing, les pêches au sirop, les pommes ou les poires cuites ou rôties, sans la peau ; le thé, le café et les tisanes.
La veille de la coloscopie ou de l’iléoscopie, le nettoyage intestinal pourra débuter à l’aide des préparations prescrites par le professionnel de santé. Il peut s’agir de solutions de polyéthylène glycol, de sels de magnésium, de solutions de phosphate de sodium ou de lavements. 3 ou 4 heures avant de commencer le nettoyage intestinal, le patient doit arrêter de manger des aliments solides.
À partir de là, il ne pourra plus boire que des liquides clairs, c’est-à-dire de l’eau, des tisanes, du bouillon filtré, du café ou du thé, des jus de fruits filtrés et des boissons rafraîchissantes claires. Le jour de l’examen, le patient doit arrêter de boire des liquides clairs 3 à 4 heures avant de subir la coloscopie ou l’iléoscopie.
Pendant et après l’iléocoloscopie
L’examen a lieu dans l’unité d’endoscopie du service de gastro-entérologie. Il sera réalisé par des spécialistes en médecine digestive ayant une formation en endoscopie diagnostique et thérapeutique réalisée au service des MICI ou, à défaut, une formation aux MICI.
Les aides-soignants et le personnel infirmier spécialisé en endoscopie y participent également. Leur rôle lors de l’iléocoloscopie est de prendre soin et de répondre aux besoins du patient, d’assister l’endoscopiste lors de l’examen et d’administrer les médicaments nécessaires.
Quant à la durée de l’examen, elle peut varier entre 20 et 60 minutes. Cela dépend de la quantité d’intestin à explorer et s’il est nécessaire d’effectuer une procédure thérapeutique pendant l’exploration. De plus, afin d’éviter tout inconfort pour le patient et de permettre la réalisation de l’examen sans douleur, une sédation et une analgésie intraveineuse sont généralement administrées.
Après l’examen, le patient est emmené dans une autre pièce où il se réveillera avec une sensation de ballonnements et d’inconfort semblable à des coliques. Cela est dû à l’air insufflé dans l’intestin pendant l’examen. et devrait disparaître en quelques heures.
Actualités
Quelles sont les manifestations extra-intestinales ophtalmologiques les plus répandues associées aux MICI ?
16 mars 2023
Pathologies
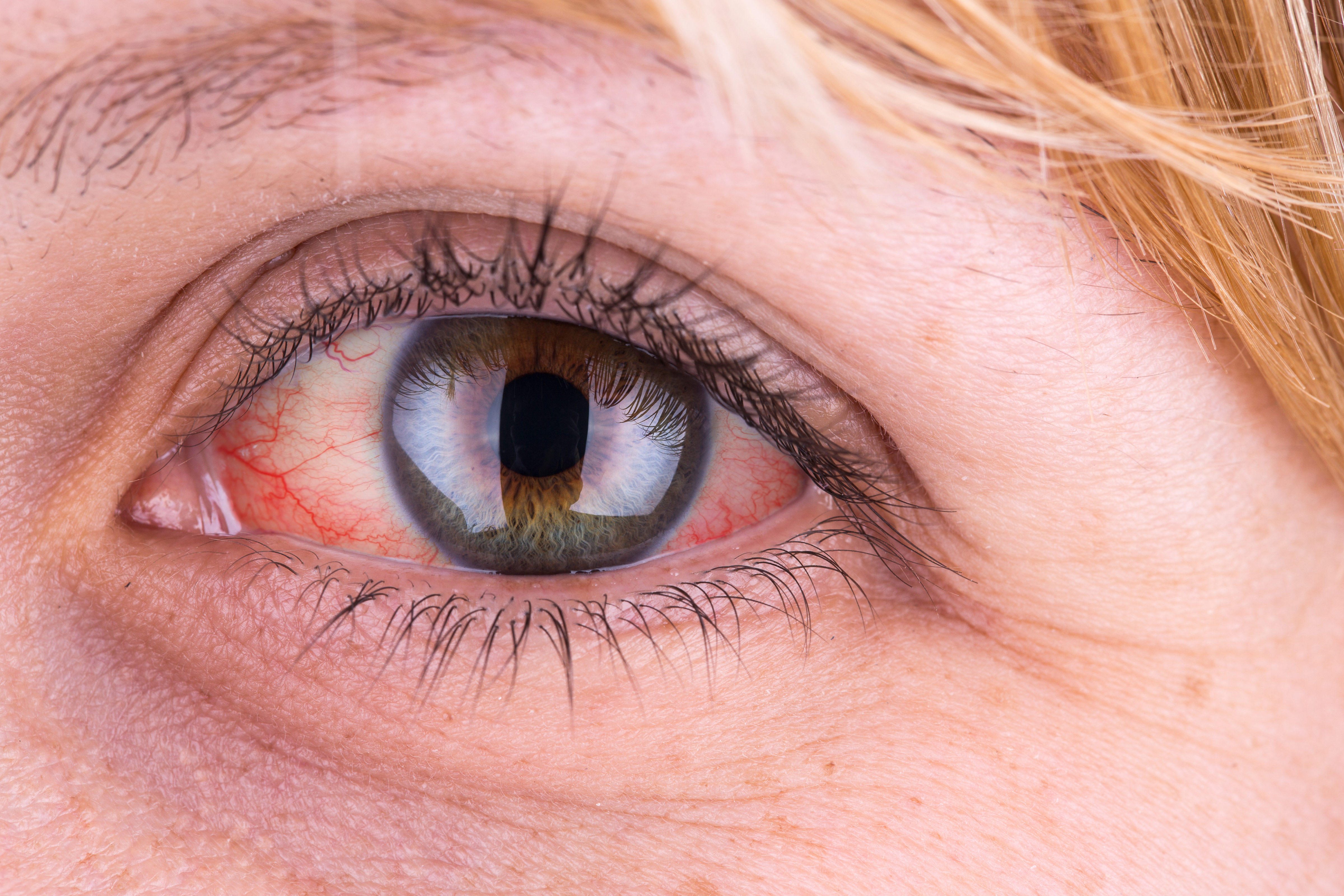
Les maladies inflammatoires chroniques de l’intestin (MICI) sont considérées comme des maladies inflammatoires systémiques. C’est-à-dire qu’en plus de toucher l’intestin, elles peuvent favoriser le développement de pathologies dans d’autres organes et systèmes, comme l’appareil visuel. Celles-ci sont connues sous le nom de manifestations extra-intestinales (MEI) et sont des maladies qui n’ont pas besoin d’être intimement liées à l’activité inflammatoire de l’intestin bien qu’elles se produisent simultanément. En réalité, leurs mécanismes de déclenchement ne sont pas exactement connus, bien que l’on pense que la cause pourrait être liée à l’interaction de facteurs génétiques et environnementaux ainsi qu’à des modifications du microbiote intestinal.
Les manifestations extra-intestinales ophtalmologiques sont rares chez les patients atteints de MICI, puisqu’elles ne concernent que 10 % d’entre eux1. La conséquence de cette faible prévalence est que les professionnels de la santé et les patients eux-mêmes négligent la possibilité que des symptômes tels que des douleurs ou des rougeurs oculaires puissent être liés à la rectocolite hémorragique2 ou à la maladie de Crohn. Une erreur qui peut avoir des conséquences graves pour les patients, mais qui demeurent évitables grâce à une approche multidisciplinaire incluant un examen ophtalmologique complet.
Les troubles oculaires les plus courants chez les patients atteints de MICI sont la sclérite, l’épisclérite et l’uvéite. Dans les deux premiers cas, la structure oculaire touchée est la sclère, connue sous le nom de blanc de l’œil, tandis que l’uvéite touche l’uvée, soit la couche située sous la sclère. Il convient de noter que l’apparition des trois troubles coïncide généralement avec d’autres manifestations cutanées et articulaires, ce qui peut être un indice pour la détection précoce des pathologies oculaires.
Symptômes et traitement de l’épisclérite et de la sclérite
L’épisclérite et la sclérite sont des manifestations extra-intestinales ophtalmologiques qui touchent le blanc de l’œil, mais chacune à des degrés divers.
L’épisclérite survient lorsque la fine couche de tissu qui recouvre le blanc de l’œil (épisclère) s’enflamme et s’irrite. Cette inflammation coïncide généralement avec une poussée de la maladie. Sa symptomatologie se caractérise par une sensation de brûlure dans l’œil qui ne s’aggrave pas à la palpation, des rougeurs, un larmoiement et une légère douleur ou inconfort.
Le traitement de l’épisclérite dépend de la gravité des symptômes. Normalement, la maladie guérit avec la mise en place du traitement de la MICI elle-même, mais celui-ci peut parfois être associé à des anti-inflammatoires non stéroïdiens administrés en collyre pour soulager l’inconfort.
Si l’épisclérite n’est pas correctement traitée à temps, elle est susceptible d’entraîner une sclérite,, un trouble oculaire plus grave susceptible de causer une perte de vision. Les symptômes de la sclérite sont une douleur intense au niveau de l’œil qui s’aggrave à la palpation et irradie vers le front, la joue ou les sinus paranasaux, ainsi que des rougeurs plus prononcées que lors d’une épisclérite.
Outre le traitement de la rectocolite hémorragique et de la maladie de Crohn, des corticoïdes systémiques, des anti-inflammatoires non stéroïdiens (AINS) ou des immunosuppresseurs comme le méthotrexate sont prescrits pour traiter et contrôler la sclérite.
Détection de l’uvéite
L’uvéite est une autre des manifestations extra-intestinales ophtalmologiques les plus répandues chez les patients souffrant d’une MICI. Elle peut apparaître aussi bien en période de rémission que lors de poussées ou même avant le diagnostic de la maladie inflammatoire elle-même. Elle se caractérise par une inflammation de l’uvée, la couche située sous le blanc de l’œil, où se trouvent un grand nombre de vaisseaux sanguins.
Lorsque l’inflammation se produit à l’avant de l’œil, on parle alors d’uvéite antérieure. Il s’agit de la forme la plus fréquente, qui se caractérise par les symptômes suivants : rougeurs des yeux, sensibilité à la lumière (photophobie), douleurs oculaires, larmoiement et vision floue. Si cette symptomatologie est associée à une diminution de la vision et/ou à l’apparition de corps flottants, le patient peut souffrir d’uvéite postérieure.
Si vous présentez l’un des symptômes décrits ci-dessus, consultez un médecin dans les plus brefs délais car les conséquences peuvent être graves, voire entraîner une perte de vision permanente. Les symptômes peuvent apparaître de manière soudaine et s’aggraver en peu de temps ou bien commencer progressivement. Cela représente donc une urgence ophtalmologique et exige un diagnostic précoce afin d’éviter les complications.
Le traitement de l’uvéite consiste à administrer des collyres cycloplégiques qui soulagent la douleur et préviennent les adhérences oculaires postérieures (synéchies). On y associe généralement des corticoïdes topiques, oculaires, périoculaires ou systémiques, voire des immunosuppresseurs pour les cas les plus graves.
Actualités
Planifier une grossesse réussie chez les femmes atteintes de MICI
6 février 2023
Patient

Lorsqu’un couple décide d’avoir des enfants, de nombreux doutes se profilent à l’horizon concernant la planification, la grossesse elle-même, l’accouchement ou l’allaitement. Une nouvelle phase de la vie qui, bien qu’elle soit marquée par de l’enthousiasme et de l’espoir, apporte aussi sont lot de peur et d’incertitude. L’une des principales craintes des futurs parents est la possibilité que le bébé naisse avec une pathologie susceptible d’affecter sa qualité de vie.
D’où l’importance de planifier une grossesse, surtout pour les patientes atteintes de maladies inflammatoires chroniques de l’intestin (MICI) comme la rectocolite hémorragique ou la maladie de Crohn. Dans ces cas précis, bien que la majorité des grossesses chez les patientes atteintes de MICI se déroulent avec succès et sans complications, il est indispensable de consulter des professionnels de santé avant la conception afin d’évaluer l’état de la patiente, de déterminer le moment opportun pour tomber enceinte ou les facteurs de risque, ainsi que les compléments vitaminiques qui devront être pris tout au long de la grossesse.
Dans cet article, nous allons expliquer en détail les aspects dont les patients atteints de MICI (et principalement les femmes) doivent tenir compte lorsqu’ils souhaitent avoir des enfants.
Première étape : la planification de la grossesse
Les couples au sein desquels au moins un des deux parents est atteint de MICI doivent planifier la grossesse afin de mettre en place certains soins et contrôles, tant pour la mère que pour le fœtus. Certains de ces bilans auront pour but de vérifier que la patiente ne présente pas de carences en vitamine B12, en fer et en acide folique, entre autres macro- et micronutriments. Outre ce point très important, il conviendra de dépister chez la patiente une éventuelle dysplasie (croissance de cellules anormales dans un tissu ou un organe) ou un cancer du col de l’utérus et du côlon, car cela affectera directement sa grossesse.
D’autre part, il convient de noter que le plus grand risque pour la mère et le fœtus est que la MICI soit active. C’est pourquoi la patiente ne doit jamais abandonner le traitement de son propre gré, ni avant ni pendant la grossesse, sous peine de souffrir d’une récidive. En effet, la majorité des grossesses compliquées (accouchement prématuré, faible poids de naissance du nouveau-né) sont causées par le processus inflammatoire lui-même. Il s’agit donc d’un aspect fondamental.
Afin que la grossesse se déroule le plus normalement possible et pour éviter les risques, la prise en charge et le suivi des femmes enceintes doivent être assurés par une équipe multidisciplinaire composée de gastro-entérologues et de chirurgiens spécialisés en MICI, ainsi que d’obstétriciens experts des grossesses à haut risque et de pédiatres spécialisés dans les nouveau-nés dont les parents souffrent de maladies inflammatoires chroniques de l’intestin.
La fertilité : MICI active vs. MICI inactive
La majeure partie des études réalisées sur la fertilité des hommes et des femmes atteints de MICI démontrent que la fertilité n’est pas impactée lorsque la maladie est inactive. Le niveau de fertilité est donc le même que dans la population générale. De plus, une grossesse sans complications est possible tant que la maladie n’est pas active.
La crainte d’effets indésirables des médicaments sur le fœtus, d’une poussée pendant la grossesse ou de ne pas pouvoir concilier maladie et enfants, amène cependant les patients à prendre la décision de ne pas avoir de descendance. Ainsi, plus que l’infertilité, le fait que le nombre de grossesses chez les patientes atteintes de rectocolite hémorragique ou de la maladie de Crohn soit inférieur à celui de la population générale est principalement dû à une décision réfléchie prise au sein de chaque couple.
Un autre obstacle, et une autre raison pour laquelle les patients atteints de MICI inactives décident volontairement de ne pas devenir parents, est l’idée que le bébé pourrait développer leur maladie. Dans ce contexte, si un seul parent est atteint de MICI, la probabilité que l’enfant développe la maladie est inférieure à 5,2 %. Ce pourcentage passe à 33 % si les deux parents souffrent d’une maladie inflammatoire chronique de l’intestin1.
Les patients atteints de MICI actives, en revanche, peuvent voir leur fertilité impactée. Parfois, une poussée ou le simple fait d’être en situation de dénutrition peuvent réduire la fertilité, bien qu’il ne s’agisse pas des seuls facteurs en jeu. D’autres mécanismes peuvent l’influencer : la propagation de l’inflammation aux trompes de Fallope et aux ovaires dans la maladie de Crohn ou des rapports sexuels douloureux (dyspareunie) lorsque la maladie active touche la région périanale active ou que des adhérences se sont formées dans le bassin à la suite d’interventions chirurgicales comme la coloproctectomie avec anastomose iléo-anale (également appelée réservoir iléo-anal).
Malgré ce scénario pessimiste, des études apportent un espoir aux patientes ayant subi une coloproctectomie avec anastomose iléo-anale et qui ont du mal à concevoir. Dans ces cas précis, les techniques de fécondation in vitro sont une possibilité envisageable car les taux de grossesse sont similaires à ceux des patientes atteintes de rectocolite hémorragique, avec ou sans anastomose iléo-anale2.
Les patientes ne doivent en aucun cas abandonner leur traitement pendant leur grossesse sans avoir d’abord consulté leur professionnel de santé. Pourquoi ? Parce qu’interrompre ou arrêter le médicament de leur propre chef serait pire et bien plus nocif que les éventuels effets indésirables du traitement.
Bien que la plupart des médicaments soient actuellement considérés comme sûrs pendant la grossesse et l’allaitement, les suivants ne sont pas compatibles avec la grossesse : méthotrexate, tofacitinib, thalidomide, 6-thioguanine (grossesse) et ciclosporine (allaitement). Chez les hommes, le traitement par sulfasalazine peut affecter de manière réversible le nombre et la mobilité des spermatozoïdes.
Afin d’éviter à la patiente de prendre des médicaments contre-indiqués lors de la grossesse ou d’abandonner le traitement de son propre chef, le professionnel de santé doit être informé (tel qu’expliqué ci-dessus) de l’intention des patients d’avoir des enfants, car ce n’est qu’à ce moment-là qu’une modification du traitement et son remplacement par d’autres médicaments ou techniques compatibles avec la grossesse (comme l’aphérèse leucocytaire) seront possibles.
Cette dernière procédure, l’aphérèse des granulocytes, est un traitement non pharmacologique qui consiste à éliminer de la circulation sanguine les types de cellules ou les médiateurs de l’inflammation en faisant passer le sang à travers une colonne remplie de sphères d’acétate de cellulose qui adsorbent/retiennent les diverses sous-populations leucocytaires inflammatoires. Ce procédé est un traitement non pharmacologique qui offre une alternative efficace et sûre aux patients qui ne répondent pas aux autres traitements ou, comme dans le cas des femmes enceintes, qui ne peuvent pas prendre certains médicaments en raison des effets secondaires qu’ils provoquent.
- FERTILIDAD Y EMBARAZO EN PACIENTES CON ENFERMEDADES INFLAMATORIAS INTESTINALES | Revista Médica Clínica Las Condes (elsevier.es)
- In Vitro Fertilization Is Successful in Women With Ulcerative Colitis and Ileal Pouch Anal Anastomosis – PubMed (nih.gov)
- FERTILIDAD Y EMBARAZO EN PACIENTES CON ENFERMEDADES INFLAMATORIAS INTESTINALES | Revista Médica Clínica Las Condes (elsevier.es)
Actualités
Aphérèse des granulocytes pour les patients atteints de rectocolite hémorragique
10 janvier 2023
Adacolumn

Le parcours des patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) et de leurs familles après un diagnostic de rectocolite hémorragique ou de maladie de Crohn est difficile. Accepter le diagnostic, consulter tous les spécialistes nécessaires, effectuer les examens permettant de connaître l’étendue de la maladie ou attendre que le bon traitement soit adapté et mis en place, ne sont que quelques-uns des obstacles et des difficultés à surmonter. Définir et administrer le bon traitement est d’ailleurs précisément l’un des aspects les plus complexes auxquels le patient sera confronté.
Prenons le cas de la rectocolite hémorragique, une pathologie responsable d’une inflammation du rectum et du côlon : le patient va souffrir de récidives avec des poussées plus ou moins intenses et plus ou moins longues. Les médicaments faisant actuellement partie de l’arsenal thérapeutique des professionnels de santé pour traiter les patients visent à induire la rémission de ces poussées et à maintenir les MICI inactives afin d’améliorer la qualité de vie du patient. Et, bien sûr, toujours avec un maximum d’efficacité et de sécurité.
Compte tenu du fait que certains patients ne répondent pas aux traitements conventionnels ou ne peuvent même pas les prendre en raison de leur profil, les professionnels de santé ont vu dans l’aphérèse des granulocytes (GMA) un allié thérapeutique avec des garanties de succès chez les patients atteints de rectocolite hémorragique. Cette technique réduit le nombre de cellules inflammatoires dans le sang sans qu’il soit nécessaire d’administrer un médicament au patient.
En quoi consiste l’aphérèse des granulocytes ?
Comme nous l’avons écrit précédemment, la GMA est un traitement non pharmacologique dont le principe consiste à faire passer le sang du patient à travers un dispositif de circulation extracorporelle afin d’en éliminer les composants pathogènes qui conditionnent ou perpétuent la maladie, contribuant ainsi au traitement.
L’un des systèmes d’aphérèse des granulocytes commercialisés en Europe se compose d’une colonne ou d’un filtre qui contient des sphères d’acétate de cellulose et permet l’adsorption sélective de 65 % des granulocytes, 55 % des monocytes/macrophages et 2 % des lymphocytes, les éliminant ainsi de la circulation sanguine.
La procédure consiste à extraire le sang de la veine ulnaire du patient. Celui-ci passe dans le circuit et la colonne d’adsorption où il est purifié, avant d’être réinjecté par la veine ulnaire controlatérale (voir la fig. 1 illustrant le processus).
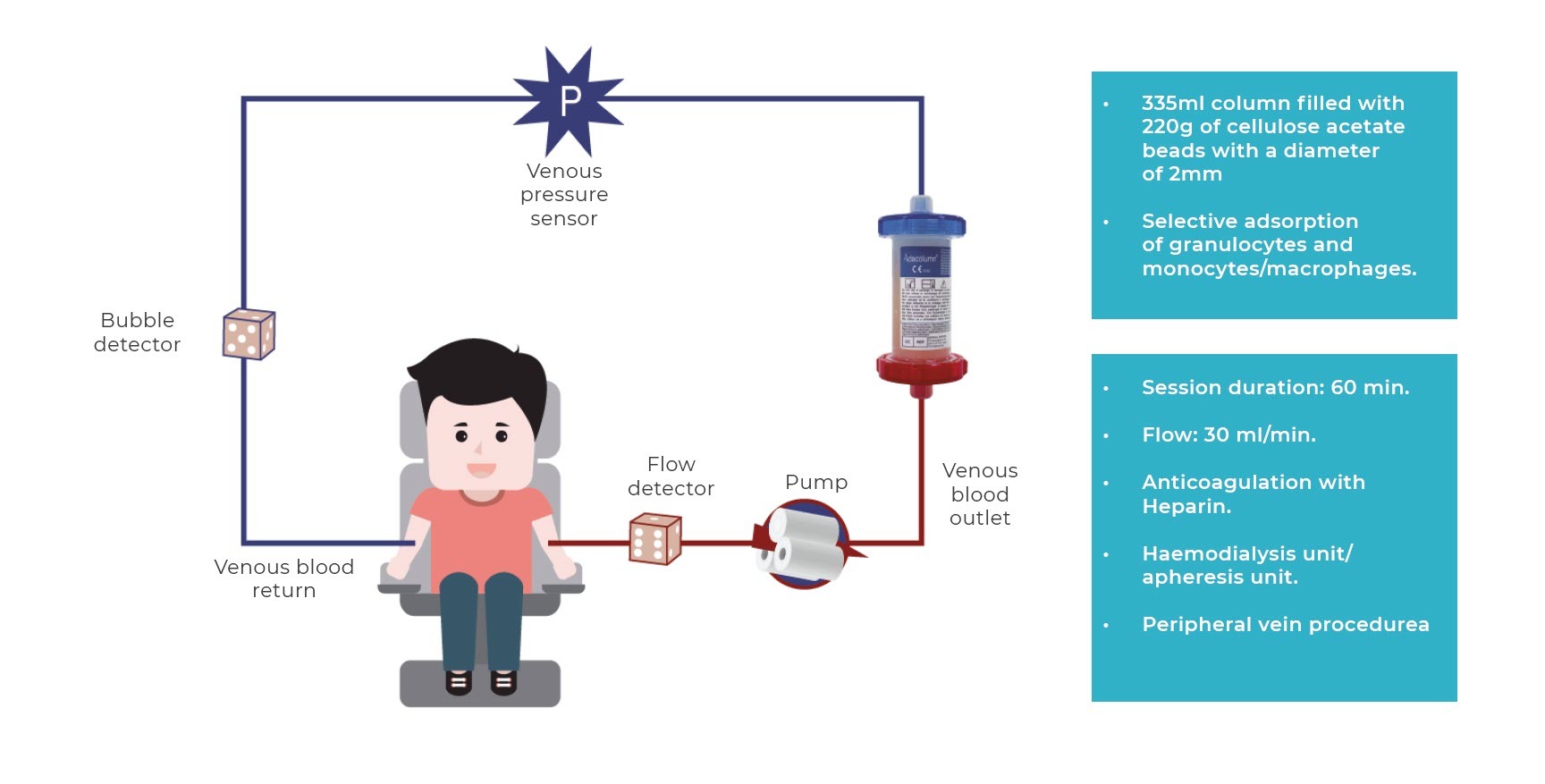
La procédure est réalisée dans des unités d’hémodialyse ou des banques de sang. Elle peut également être effectuée, après une formation adéquate, dans des services de traitement en ambulatoire. Le schéma d’application de la technique (fréquence et nombre de séances) varie de 5 à 10 séances (à raison de 1 ou 2 séances par semaine) d’une durée d’au moins 60 minutes, bien que la pratique clinique réelle dans la plupart des hôpitaux consiste en 10 séances (à raison de 2 séances/semaine les 3 premières semaines afin d’accélérer la réponse, puis de 1 séance par semaine jusqu’à la fin des 10 semaines) plus longues (généralement de 90 minutes), car ce schéma posologique s’est avéré sûr et bien toléré, obtenant de meilleurs résultats cliniques.
Cependant, la seule limite pratique à sa mise en œuvre est la difficulté d’accès et d’acheminement des cathéters veineux périphériques, qui peut nécessiter la mise en place d’un cathéter veineux central.
À l’heure actuelle, le mécanisme d’action exact de la GMA n’est pas encore connu. On sait cependant que les granulocytes et les monocytes/macrophages sont élevés et activés dans le sang périphérique dans de nombreuses maladies auto-immunes, que leur nombre est corrélé à l’activité et à la gravité de la maladie, et qu’ils jouent un rôle clé dans l’immunopathogenèse car ils produisent des quantités élevées de cytokines pro-inflammatoires responsables de lésions tissulaires.
L’une des hypothèses serait que le principal mécanisme d’adsorption de la GMA est lié à l’activation de la cascade du système du complément et entraîne l’adhérence des granulocytes à la colonne. Les leucocytes exprimant le récepteur Fc gamma (FcγR) et les récepteurs du complément (Mac-1, CD11b/CD18) adhèrent aux billes d’acétate de cellulose par activation du complément. Ainsi, la diminution du réservoir de granulocytes activés dans la circulation systémique est compensée par la mobilisation, depuis la moelle osseuse vers la circulation sanguine, de jeunes granulocytes non activés (CD10–), incapables de migrer vers le foyer inflammatoire.
De la même manière, il se produit un changement fonctionnel dans les monocytes activés qui expriment les marqueurs CD14+CD16+, ce qui dans son ensemble conduit à une diminution de la production de cytokines pro-inflammatoires et à une augmentation des médiateurs de l’inflammation en circulation ; en d’autres termes, il s’agit d’un phénomène d’immunomodulation et par conséquent d’une réduction de l’infiltrat inflammatoire et des lésions tissulaires.
La conséquence directe de l’élimination des leucocytes du système circulatoire est la mobilisation par la moelle osseuse de jeunes leucocytes inactivés, incapables de migrer vers le foyer inflammatoire. Et en plus de réduire le nombre total de cellules inflammatoires dans le sang, le passage de celui-ci dans la colonne modifie également la surface des cellules qui retournent dans le corps, induisant une série de changements au niveau immunitaire qui favorisent l’activation des mécanismes anti-inflammatoires inhibés, déclenchant alors l’inhibition de l’inflammation. En plus de produire une immunomodulation (un changement survenant dans le système immunitaire), l’inflammation et les lésions tissulaires (des cellules) de la muqueuse intestinale sont réduites.
Pour quels patients l’utilisation de la GMA est-elle indiquée ?
Il existe actuellement un arsenal thérapeutique très important pour le traitement des MICI, bien que ces médicaments soient inefficaces ou aient des effets indésirables chez certains patients.2 Par conséquent, d’autres options thérapeutiques sont nécessaires pour contrôler la progression de la maladie et éviter les interventions chirurgicales. La GMA est donc une alternative thérapeutique envisageable dans certains scénarios. Cette technique peut être appliquée dans différentes situations, y compris celles où les patients ne répondent pas de manière adéquate aux traitements pharmacologiques conventionnels ou développent une corticodépendance, en prévention des récidives et lorsque l’initiation d’un traitement immunosuppresseur ou une biothérapie est envisagée3,4.
Même si l’on recherche toujours le meilleur traitement pour chaque cas, il existe un pourcentage élevé de patients atteints de rectocolite hémorragique qui ne répondent pas aux traitements conventionnels, qu’ils soient à base de corticoïdes ou de thiopurine (un immunomodulateur) (Ardizzone et al, 2006) ou qu’il s’agisse d’un traitement par anti-TNF. Jusqu’à il y a quelques années, lorsqu’un professionnel de la santé se retrouvait face à une situation où les médicaments n’amélioraient pas l’état du patient, l’option la plus utilisée pour le traiter et améliorer sa qualité de vie était la chirurgie.
Mais au cours des dernières décennies, d’autres alternatives thérapeutiques plus sûres comme la GMA sont apparues pour les patients atteints de rectocolite hémorragique. Elles peuvent être appliquées aux patients suivants1:
- Patients adultes corticodépendants atteints de rectocolite hémorragique après l’échec, l’intolérance ou un risque élevé associé aux traitements immunomodulateurs et/ou biothérapies2.
- Patients âgés avec comorbidités.
- Patientes enceintes.
- Patients pédiatriques atteints de rectocolite hémorragique.
Contre-indications :
- Allergie à l’héparine et thrombopénie induite par l’héparine
- Numération des granulocytes inférieure à 2 000 /MI
- Anémia significative (Hb < 8 g/dl)
- Coagulopathie grave
- Infection active
- Cardiopathie ou néphropathie grave
Précautions :
Prudence en cas d’hypercoagulabilité (fibrinogène > 700 mg/ml) ou de déshydratation (diarrhée ou états fébriles récents). Ces facteurs doivent être corrigés au préalable.
GMA, un signe de sécurité et d’efficacité dans le traitement de la RH
S’il y a deux caractéristiques qui définissent la GMA, ce sont sa sûreté et son efficacité. Selon le projet Prodiggest3, cette option thérapeutique a fait l’objet d’études et de méta-analyses afin de pouvoir être qualifiée d’alternative efficace et sûre pour les patients.
D’une part, la GMA est décrite comme très sûre pour les patients atteints de rectocolite hémorragique car les effets indésirables des traitements conventionnels disparaissent. Les effets secondaires de la GMA sont pour la plupart légers et temporaires, le patient peut donc poursuivre le traitement. Il s’agit notamment de maux de tête, de frissons, d’une légère fièvre, de nausées, de fatigue, de myalgies, de palpitations, d’hypotension ou de rougeurs. Dans de nombreux cas, les effets indésirables sont davantage liés à la technique d’aphérèse qu’au traitement par GMA lui-même (problèmes de voies, etc.), d’où l’importance qu’il soit réalisé par des professionnels expérimentés.
D’autre part, en plus de son efficacité chez les patients pédiatriques, les femmes enceintes, les personnes âgées ou les patients corticodépendants et corticorésistants, il existe d’autres scénarios dans lesquels la GMA est efficace. Comme indiqué dans le projet Prodiggest, elle peut être utilisée en traitement de première intention avec un taux d’induction de rémission de 70 % face à une rectocolite hémorragique distale d’activité légère à modérée (Yamamoto et al 2004) et jusqu’à 80 % chez les patients dont la maladie a peu évolué et naïfs de corticoïdes (Takemoto et al 2007).
De plus, c’est une option qui peut prévenir la récidive dans certains cas de patients à haut risque de poussées récurrentes difficiles à contrôler. En ce sens, il est possible d’établir une durée moyenne de rémission clinique obtenue après une GMA de 10 mois chez les patients atteints de rectocolite hémorragique (Ljung et al 2007), voire d’un an si la maladie a été prise en charge tôt ou que peu de traitements ont été administrés au patient avant la GMA (corticoïdes, thiopurines, biothérapie, etc.).
- https://www.aegastro.es/publicaciones/publicaciones-aeg/protocolos-asistenciasles-prodiggest/uso-racional-de-la-granulocitomonoaferesis-en-la-enfermedad-inflamatoria-intestinal
- Traitement de la rectocolite hémorragique chez les patients corticodépendants et en échec des biologiques : Adacolumn – Adacyte
- https://www.aegastro.es/publicaciones/publicaciones-aeg/protocolos-asistenciasles-prodiggest/uso-racional-de-la-granulocitomonoaferesis-en-la-enfermedad-inflamatoria-intestinal
- Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, AllezM, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: Currentmanagement. J Crohns Colitis. 2012;6:991—1030.
- Dignass A, Akbar A, Hart A, et al. Safety and efficacy of granulocyte/monocyte apheresis in steroid-dependent active ulcerative colitis with insufficient responseor intolerance to immunosuppressants and/or biologics [the ART trial]: 12-week interim results. J Crohns Colitis. 2016;10:812–820.
- Dittrich K, Richter M, Rascher W, et al. Leukocytapheresis in a girl with severe ulcerative colitis refractory to corticosteroids, infliximab, and cyclosporine A. Inflamm Bowel Dis. 2008;14:1466–1467.
Actualités
La maladie inflammatoire chronique de l’intestin chez les patients âgés
13 décembre 2022
Patient

Surveiller son alimentation et rester actif physiquement sont les clés d’un mode de vie sain. Bien que cela soit important à tout âge, ça l’est encore plus si nous voulons vieillir en bonne santé. En effet, c’est à ce stade de l’existence, en particulier après 60 ans, que des pathologies telles que les maladies inflammatoires chroniques de l’intestin (MICI) peuvent faire leur apparition. Parmi les patients âgés qui reçoivent pour la première fois un diagnostic de rectocolite hémorragique1 ou de maladie de Crohn, 65 % ont entre 60 et 69 ans, 25 % entre 70 et 79 ans et 10 % ont plus de 80 ans.2
Les maladies inflammatoires chroniques de l’intestin s’accompagnent généralement d’un autre type de pathologies secondaires appelées manifestations extra-intestinales (MEI) qui touchent la peau, les yeux ou les articulations, bien que cela soit moins fréquent chez les patients âgés. Il en va de même pour les interventions chirurgicales, les récidives post-chirurgicales et l’apparition de formes plus agressives ou plus sévères de MICI.
Malnutrition, anémie et ostéoporose chez les patients âgés souffrant de MICI
Chez les personnes âgées, notamment celles qui souffrent de MICI, avoir une alimentation3 variée, complète et équilibrée est indispensable, mais ce n’est pas toujours possible. Des problèmes peuvent survenir dans le processus de mastication et de déglutition en raison de la perte des dents et d’une diminution de la salivation ou bien le processus digestif peut se dégrader en raison d’une réduction de la quantité et de la qualité des sécrétions digestives qui, associées à une atrophie des muqueuses intestinales, entraîne une absorption et une utilisation inefficaces de certains nutriments, principalement les protéines, les vitamines et les minéraux.
Se pose alors un problème de malnutrition en raison d’un appauvrissement de l’alimentation, ce qui provoque une anémie4. Même si ce n’est pas la seule raison. Les patients âgés atteints de MICI peuvent également souffrir d’anémie et de malnutrition causées par la perte de sang via le système digestif. D’où la nécessité pour les patients âgés atteints de rectocolite hémorragique et de maladie de Crohn d’assurer un apport quotidien d’aliments riches en fer, notamment le poisson, la viande et les œufs.
La malnutrition chez les patients âgés atteints de MICI est également l’une des causes d’apparition de l’ostéoporose. En effet, le manque de calcium, de phosphore, de magnésium, de vitamine D et d’autres éléments nécessaires à la formation des os, entraîne une perte de densité minérale osseuse et un affaiblissement ou une fragilité des os, augmentant ainsi le risque de fractures.
Afin de prévenir l’ostéoporose chez les patients de plus de 60 ans, il est recommandé d’arrêter de fumer, d’assurer un apport correct en calcium et en vitamine D et de pratiquer une activité physique régulière. Une activité physique modérée augmente la masse osseuse et renforce les muscles. La danse, la marche, la course, l’aérobic, monter les escaliers ou soulever des poids ne sont que quelques-unes des activités recommandées pour la population à risque d’ostéoporose.
Traitement des patients âgés atteints de MICI
Les critères des professionnels de santé, visant à sélectionner le traitement et à établir des directives pour les patients âgés atteints de rectocolite hémorragique ou de la maladie de Crohn, sont généralement similaires à ceux pris en compte pour déterminer la médication de tout autre groupe de la population. L’efficacité et les résultats que l’on peut attendre des médicaments sont également similaires.
Cependant, lorsque les patients de plus de 60 ans présentent des comorbidités, l’impact des effets indésirables des médicaments peut être plus important. Dans ces cas précis, les médecins spécialistes disposent d’options de traitement telles que l’aphérèse leucocytaire (GMA)5 dans leur arsenal thérapeutique. Grâce à ce traitement non pharmacologique, les leucocytes activés responsables de l’inflammation intestinale sont éliminés du sang de manière sûre pour le patient. Cela augmente la sécurité et minimise les risques pour les patients fragiles tels que les personnes âgées.
- What is ulcerative colitis? – Adacyte
- https://educainflamatoria.com/pacientes-eii-edad-avanzada/
- Cinq clés pour suivre un régime approprié si j’ai une Rectocolite Hémorragique – Adacyte
- Lien entre anémie et Maladie inflammatoire chronique de l’intestin – Adacyte
- Traitement de la rectocolite hémorragique chez les patients corticodépendants et en échec des biologiques : Adacolumn – Adacyte
Actualités
Intervention chirurgicale pour une rectocolite hémorragique : avant, pendant et après
8 novembre 2022
Pathologies
Les médecins disposent d’un large arsenal thérapeutique pour traiter leurs patients atteints de rectocolite hémorragique. Les médicaments disponibles gardent la maladie inactive ou en rémission dans la plupart des cas. Malgré tout, entre 25 et 40 % des patients qui en sont atteints auront besoin d’une intervention chirurgicale à un moment donné dans leur parcours de soin1.
Contrairement à ce qui se passe pour la maladie de Crohn2, dans le cas de la rectocolite hémorragique, l’intervention est curative. En effet, comme cette maladie touche le rectum et le côlon, le fait de retirer ces organes entraîne la guérison totale du patient.
L’intervention est notamment indiquée3 lorsque le traitement pharmaceutique ne parvient pas à maîtriser les symptômes de la rectocolite hémorragique, que des complications telles qu’une sténose (rétrécissement ou réduction du diamètre interne de l’intestin), une perforation, des saignements graves, des abcès ou des fistules surviennent, que des lésions pré-malignes ou cancéreuses se développent ou qu’une maladie périanale apparaît et nécessite un drainage chirurgical, qu’il s’agisse d’une colostomie (dérivation) pour isoler les fistules du passage des selles ou d’une protection plus importante dans les cas plus graves.
Préparation du patient avant l’intervention
Le chirurgien et le gastro-entérologue étudient l’évolution de la rectocolite hémorragique chez le patient et définissent l’étendue et la sévérité des symptômes. Ensuite, ils informent le patient de la technique la plus adaptée à sa situation ainsi que des avantages, inconvénients et risques qui y sont associés4.
Avant l’intervention5, le patient se soumet à une évaluation pré-opératoire qui comprend une prise de sang, une analyse d’urine, une radio du thorax et un électrocardiogramme. De plus, il est très important que le patient soit en bon état de santé général et qu’il stoppe le traitement en cours (corticostéroïdes, immunosuppresseurs ou traitement biologique, aphérèse des granulocytes…) le cas échéant.
Deux jours avant l’intervention, le patient doit adopter une alimentation liquide qui, combinée à une préparation de l’intestin, permettra de s’assurer que ce dernier est exempt de déchets ou de traces de selles.
Interventions chirurgicales dans le traitement de la rectocolite hémorragique
Le gastro-entérologue et le chirurgien peuvent choisir parmi différentes techniques chirurgicales pour traiter la rectocolite hémorragique6. L’une d’entre elles se distingue particulièrement : la proctocolectomie totale avec iléostomie ou réservoir iléo-anal. Il est également très fréquent de réaliser une colectomie totale avec anastomose iléo-rectale et une colectomie subtotale avec iléostomie et fistule muqueuse rectosigmoïdienne.
Lorsqu’une proctocolectomie totale est réalisée, l’intégralité du rectum et du côlon sont retirés. Si l’on décide d’effectuer une proctocolectomie totale avec iléostomie, une ouverture est pratiquée afin de relier l’iléon à l’extérieur (iléostomie) afin d’éliminer les déchets intestinaux dans une poche (stomie).
Dans le cas où les professionnels de la santé optent pour une proctocolectomie restauratrice ou un réservoir iléo-anal, on crée avec une partie de l’intestin grêle (iléon) un réservoir interne ou une poche qui sera rattaché à l’anus et servira de nouveau rectum.
La technique appelée colectomie totale avec anastomose iléo-rectale consiste à retirer l’intégralité du côlon et à rattacher (anastomose) l’iléon au rectum. Enfin, dans le cas de la colectomie subtotale avec iléostomie et fistule muqueuse rectosigmoïdienne, seules les zones endommagées du côlon sont retirées et une iléostomie est réalisée. Si le côlon sigmoïde (extrémité du côlon) n’est pas touché, on le laisse intact et il communique avec l’extérieur par l’anus ou par une fistule muqueuse réalisée dans la paroi abdominale afin que les sécrétions puissent être évacuées.
Que se passe-t-il après l’intervention chirurgicale ?
Après l’intervention destinée à traiter la rectocolite hémorragique, le patient est en convalescence. Au départ, il ne sera pas capable d’ingérer quelque nourriture que ce soit. Il recevra uniquement des nutriments par voie parentérale (intraveineuse). Une fois que le mouvement intestinal aura repris, le patient pourra progressivement commencer à consommer des liquides, puis des solides.
Par la suite, il est fréquent que le patient évacue des traces de sang, du mucus ou des selles par le rectum, parfois sans pouvoir s’en empêcher. Cela s’appelle l’incontinence rectale. Si le rectum est intact, cette évacuation ne sera pas douloureuse. La fréquence de ces sécrétions diminuera avec le temps.
Dans le cas d’une stomie, le patient devra commencer à s’habituer à sa nouvelle situation le plus tôt possible. Ses fonctions intestinales seront bouleversées, son image de lui-même va changer et il devra porter une poche de stomie. Au cours de son hospitalisation, les professionnels de santé aideront le patient et sa famille à s’adapter, en leur donnant toutes les informations et tous les conseils nécessaires.
Cependant, étant donnés les bouleversements de la qualité de vie du patient et les complications généralement associées à cette intervention (à relier à un nouvel article sur ce sujet), celle-ci constitue généralement la dernière option choisie, lorsque tous les autres traitements disponibles ont échoué à garder la rectocolite hémorragique sous contrôle.
- https://www.elsevier.es/es-revista-cirugia-espanola-36-articulo-estado-actual-del-tratamiento-quirurgico-S0009739X12003119
- Ulcerative colitis and Crohn similarities – Adacyte
- https://www.elsevier.es/es-revista-cirugia-espanola-36-articulo-estado-actual-del-tratamiento-quirurgico-S0009739X12003119
- https://www.educainflamatoria.com/que-preparacion-previa-tiene-una-cirugia-de-eii
- https://www.elsevier.es/es-revista-enfermedad-inflamatoria-intestinal-al-dia-220-articulo-manejo-perioperatorio-enfermedad-inflamatoria-intestinal-S1696780115000767
- What is ulcerative colitis? – Adacyte
Actualités
Traitement biologique pour la rectocolite hémorragique : une révolution thérapeutique
13 octobre 2022
Pathologies

Au cours de ces 30 dernières années, le traitement des Maladies inflammatoires chroniques de l’intestin (MICI) a connu une véritable révolution. Les professionnels de santé ont ajouté à leur arsenal thérapeutique de nouvelles molécules qui se sont révélées très efficaces dans le traitement de la maladie de Crohn et de la rectocolite hémorragique. Ces molécules ont également permis d’étendre les options thérapeutiques disponibles pour les patients et d’avancer vers une médecine plus individualisée. Il s’agit des anticorps monoclonaux.
Ces nouveaux médicaments reposent sur des mécanismes d’action différents de ceux auxquels nous sommes habitués. C’est pourquoi ils permettront, dans un futur très proche, de gérer la maladie de manière bien plus diversifiée encore. Selon les spécialistes, la plus grande révolution dans ce domaine est encore à venir. À l’heure actuelle, ils travaillent sur un traitement efficace pour les patients souffrant de poussées modérées à sévères et qui ne répondent pas bien aux traitements conventionnels ou sont intolérants/présentent des contre-indications à ceux-ci.
Quels sont les traitements biologiques de la rectocolite hémorragique ?
Les anticorps monoclonaux constituent un type de protéine qui se lie à une cytokine (un autre type de protéine) de l’organisme appelée le facteur de nécrose tumorale alpha (TNF-α). Le traitement biologique bloque donc l’activité du TNF. Cette cytokine est l’une des molécules responsables du processus inflammatoire lors d’une poussée1 chez les patients souffrant d’une MICI comme la rectocolite hémorragique.
On parle dans ce cas de composés complexes synthétisés par un organisme ou une cellule vivante qui sont génétiquement modifiés grâce à la technologie et au génie génétique, en d’autres termes, au moyen d’un processus de biotechnologie efficace et précis qui permet de manipuler ces cellules ou micro-organismes.
On peut donc dire que le traitement biologique de la rectocolite hémorragique améliore la qualité de vie des patients. En effet, contrairement à d’autres médicaments existants, ces nouveaux traitements biologiques permettent d’obtenir une rémission de la maladie pendant de plus longues périodes. Ainsi, les patients peuvent effectuer leurs activités quotidiennes normalement, sans présenter aucun symptôme.
Quand et comment le traitement biologique est-il administré ?
Les traitements biologiques sont indiqués à la fois en première intention et en cas de rémission de la rectocolite hémorragique. Avant de recommander leur utilisation, les professionnels de santé vont vérifier le statut vaccinal du patient et son immunisation face à certaines infections.
Ils vont également écarter une infection latente par la tuberculose. Si le patient se trouve dans cette situation, la bactérie responsable de la tuberculose se trouve dans son organisme, vivante mais inactive. Par conséquent, il ne présentera aucun symptôme jusqu’à l’activation de celle-ci. Des tests tels qu’une radio du thorax, une prise de sang et un test de détection de la tuberculine (mantoux) seront réalisés pour écarter cette possibilité.
Ensuite, le médecin va choisir quel traitement biologique administrer au patient parmi l’arsenal à sa disposition. Puis, il déterminera la dose et le moment le plus adapté pour commencer ce traitement de la rectocolite hémorragique.
Deux modes d’administration peuvent être utilisés2 en fonction du produit choisi :
- En intraveineuse. Le médicament est administré à l’hôpital via une voie veineuse. L’administration sera lente pour éviter toute réaction au produit. C’est ainsi que l’infliximab et le védolizumab sont administrés.
- Par voie sous-cutanée. Le produit peut être injecté à domicile par le patient lui-même, comme s’il s’agissait d’une piqûre d’insuline. L’adalimumab et le golimumab sont administrés de cette manière.
Dans le cas de l’ustékinumab, la première dose est administrée en intraveineuse. Les doses suivantes seront injectées par voie sous-cutanée.
Diversité des traitements biologiques de la rectocolite hémorragique
L’approbation de l’infliximab a marqué un tournant dans le traitement des patients atteints d’une Maladie inflammatoire chronique de l’intestin en général et de ceux souffrant de rectocolite hémorragique en particulier. En effet, c’est le premier traitement de cette famille qui a été rendu disponible auprès des médecins. Cependant, il n’a pas été le seul traitement biologique à être approuvé.
Il existe d’autres substances appartenant au groupe des anticorps anti-TNF ou des inhibiteurs du TNF. C’est le cas de l’adalimumab et du golimumab, ainsi que des biosimilaires de l’infliximab et de l’adalimumab.
De son côté, le védolizumab est un antagoniste du récepteur de l’intégrine. L’objectif de cette substance active est de limiter l’entrée de cellules inflammatoires dans l’intestin. Pour ce faire, elle bloque les intégrines, des récepteurs membranaires qui autorisent le passage des globules blancs et des lymphocytes dans l’intestin. L’ustékinumab est l’un des derniers traitements biologiques à avoir été approuvé. Il vise à bloquer l’action des interleukines 12 et 23. Ces protéines sont impliquées dans la régulation de la réponse inflammatoire. Lorsque leur taux est élevé, cela déclenche l’activation et la prolifération des lymphocytes, qui entraîne à son tour une réponse inflammatoire de l’organisme.
Effets secondaires des traitements biologiques de la rectocolite hémorragique
En général, les effets secondaires des traitements biologiques sont légers. Assez communément, les patients se sentent fatigués et présentent des réactions cutanées, des nausées, des vomissements, des douleurs musculaires ou articulaires et de la fièvre3.
Lorsque le traitement est administré par intraveineuse, par exemple l’infliximab, l’adalimumab ou le golimumab, les patients signalent parfois des réactions. Il peut s’agir d’un souffle court, d’urticaire, de rougeurs, de démangeaisons et d’un gonflement des lèvres et de la gorge, ou de maux de tête. Si cela se produit, la perfusion est stoppée afin de pouvoir reprendre à un rythme plus lent. Lors des perfusions suivantes, le patients prendra des corticostéroïdes avant l’injection du produit.
De leur côté, les patients traités à l’adalimumab ou au golimumab peuvent constater une réaction cutanée au point d’injection en sous-cutané.
De manière générale, les traitements biologiques peuvent accroître le risque d’infection, notamment respiratoire. Par conséquent, les professionnels de santé recommandent d’être bien à jour dans ses vaccins. Et si vous présentez des symptômes d’infection, comme une toux ou de la fièvre, n’hésitez pas à consulter votre médecin.
Actualités
Lien entre anémie et Maladie inflammatoire chronique de l’intestin
14 septembre 2022
Pathologies

L’anémie constitue l’une des complications les plus fréquentes chez les patients atteints d’une Maladie inflammatoire chronique de l’intestin (MICI). Bien que les données varient en fonction des études, on estime que 30 à 50 % de ces patients en souffrent. Cette complication se manifeste par une fatigue chronique, un symptôme qui a un impact non négligeable sur la qualité de vie des malades. En effet, cela peut affaiblir le patient autant voire davantage que les douleurs abdominales ou la diarrhée. De plus, l’anémie peut entraîner une hausse de la morbidité du patient, avec une hausse du nombre de transfusions, d’admissions à l’hôpital et de la durée moyenne du séjour en établissement de soins1.
Éviter les conséquences de l’anémie dans le cadre d’une Maladie inflammatoire chronique de l’intestin est l’un des principaux objectifs du gastro-entérologue. Dans sa quête pour améliorer la qualité de vie de ces patients, le médecin s’attache à identifier correctement les patients anémiques et à établir le traitement le plus approprié. En effet, il considère l’anémie comme un facteur important de la détection, de l’évolution et du traitement de pathologies telles que la rectocolite hémorragique2. Certains professionnels accordent même à l’anémie le statut de pathologie à part entière.
Qu’est-ce que l’anémie ?
L’anémie désigne la baisse du nombre de globules rouges ou d’hémoglobine dans le sang. À cause de ce phénomène, la quantité d’oxygène transportée depuis les poumons vers les autres tissus est insuffisante et les cellules ne fonctionnent donc pas correctement. Selon l’Organisation mondiale de la Santé (OMS), un individu est anémié lorsque le taux d’hémoglobine dans le sang est inférieur à 13 g/dL chez les hommes et 12 g/dL chez les femmes. Une valeur de 10 g/dL est considérée comme une anémie sévère.
Pour résumer, l’anémie survient lorsque le nombre de globules rouges détruits dépasse le nombre de globules rouges créés par l’organisme. Parmi les symptômes qui peuvent indiquer au patient la présence de cette manifestation extra-intestinale, on trouve entre autres les maux de tête, la fatigue, la tachycardie, l’irritabilité, des cheveux et des ongles cassants, les nausées, les vertiges, les acouphènes, la dyspnée ou encore l’affaiblissement des capacités cognitives. Si vous présentez plusieurs de ces symptômes, il est vivement conseillé de consulter un médecin qui vous prescrira une prise de sang afin de confirmer l’anémie.
Causes de l’anémie chez les patients atteints d’une MICI
Chez les patients souffrant d’une Maladie inflammatoire chronique de l’intestin, plusieurs facteurs ou mécanismes déclencheurs de l’anémie coexistent généralement. Cependant, malgré son étiologie multifactorielle, on peut distinguer deux causes majeures :
- Premièrement, la perte de fer. On appelle cela l’anémie ferriprive et il s’agit de la principale cause de cette complication. Elle est généralement due à une perte de sang via les lésions intestinales qui passe inaperçue. Lorsque l’on perd du sang, on perd également du fer et de l’hémoglobine.
- Deuxièmement, son apparition peut aussi être due aux troubles inflammatoires chroniques. Dans ce cas, on parle d’anémie de l’inflammation ou de la maladie chronique. Les cytokines ou cytokines pro-inflammatoires (des protéines caractéristiques des poussées de la MICI) entraînent une défaillance dans le fonctionnement de la moelle osseuse, ce qui engendre une baisse de production d’hémoglobine. Ce phénomène coexiste souvent avec l’anémie ferriprive.
L’anémie chez les patients atteints d’une MICI peut également être due à une carence en vitamine (par exemple en acide folique et en vitamine B12), à l’action de certains médicaments comme les aminosalicylates et les dérivés de la thiopurine, ou à l’anémie hémolytique qui touche davantage les patients atteints de rectocolite hémorragique3.
Connaître la cause du trouble pour trouver le meilleur traitement contre l’anémie dans les cas de Maladie inflammatoire chronique de l’intestin
Bien que légère, la carence ou la perte de fer chez les patients atteints d’une Maladie inflammatoire chronique de l’intestin ne doit pas être considérée comme un indicateur négligeable. Bien au contraire. Elle constitue le symptôme d’un mauvais ajustement du traitement de la rectocolite hémorragique ou de la maladie de Crohn.
Par exemple, si une évaluation du patient montre que la MICI est active, le traitement doit être adapté pour maîtriser la poussée et éliminer l’anémie.
Si le patient souffre d’une anémie ferriprive, l’inflammation due à la MICI doit être surveillée en priorité. Il peut même être nécessaire de modifier son traitement. Pour traiter l’anémie, on peut utiliser divers compléments oraux en fer, injecter directement du fer en intraveineuse ou, le cas échéant, prescrire des compléments en acide folique et en vitamine B12. On peut également conseiller au patient d’adopter une alimentation riche en fer en complément ainsi que pour éviter ce type d’anémie.
Actualités
La rectocolite hémorragique est-elle une cause d’invalidité ?
24 août 2022
Pathologies

La rectocolite hémorragique est une maladie chronique qui, si elle est bien maîtrisée, permet aux patients de bénéficier d’une bonne qualité de vie. Par conséquent, un diagnostic de maladie inflammatoire chronique de l’intestin n’implique pas automatiquement la reconnaissance d’une invalidité. Cependant, dans certains cas, le patient ne peut pas profiter d’une vie étudiante, professionnelle ou sociale normale, car sa maladie est active de façon permanente ou intermittente. C’est à ce moment-là qu’on parle d’invalidité due à la rectocolite hémorragique.
L’invalidité est reconnue comme un moyen objectif de mesurer l’impact d’une maladie sur la vie quotidienne. Elle est définie par l’OMS (Organisation mondiale de la santé) comme « toute restriction ou absence de capacité à effectuer une activité d’une manière considérée comme normale ».
Types d’invalidité en fonction de la sévérité de la rectocolite hémorragique
L’invalidité peut être considérée comme passagère et temporaire ou comme permanente et irréversible. L’invalidité temporaire désigne l’invalidité passagère que connaît un patient lorsqu’il souffre d’une poussée. Autrement dit, on parle d’invalidité temporaire lorsqu’un patient traverse une poussée sévère1 car son invalidité persiste tant que les symptômes sont présents.
De l’autre côté, l’invalidité permanente survient lorsque l’impact négatif sur la qualité de vie est continu. Cela peut aussi concerner les cas dans lesquels le patient ne souffre pas de lésions irréversibles. Cela serait par exemple le cas pour des patients présentant des séquelles post-opératoires ou d’autres complications entraînant des changements irréversibles.
Comment mesurer l’influence de l’invalidité sur la qualité de vie des patients ?
La perception qu’a le patient de l’impact de la rectocolite hémorragique sur sa qualité de vie est mesurable. On utilise pour cela le Health-Related Quality of Life (HRQOL). Cet outil permet de fournir au médecin des consignes pour compléter le questionnaire HRQOL2, une série de points (questions) pour lesquels différentes réponses sont proposées. Ces points sont en général regroupés par domaines et mesurent différents paramètres de la santé, comme le fonctionnement physique, psychologique et social.
Le passage du test par le patient permet d’évaluer les signes et les symptômes de la pathologie. On peut également évaluer la limitation ou l’altération du bien-être psychologique, des capacités physiques et des activités sociales du patient dues à la rectocolite hémorragique. Les réponses du patient donnent un score qui permet d’obtenir un aperçu de son état ou de sa qualité de vie. Grâce à ces outils, les professionnels de santé peuvent améliorer le bien-être des patients atteints de rectocolite hémorragique3.
Est-il possible d’éviter l’invalidité due à la rectocolite hémorragique ?
Étant donnée la possibilité d’apparition d’une invalidité due à la rectocolite hémorragique, qu’elle soit permanente ou temporaire, la meilleure des préventions consiste à garder la maladie sous contrôle et sous étroite surveillance. D’où l’importance de se rendre aux rendez-vous médicaux prévus, de suivre les recommandations données en consultation et d’observer le traitement prescrit par le médecin.
Lorsque la rectocolite hémorragique est contrôlée, l’inflammation de la muqueuse intestinale disparaît, c’est-à-dire que la maladie est en rémission4. Avec elle, dans la plupart des cas, le handicap disparaît également. En fait, une étude récente a montré que les patients atteints de rectocolite hémorragique traités par un anticorps inhibiteur du TNF et ayant répondu pleinement au traitement présentaient un risque plus faible de développer un handicap que ceux qui n’avaient pas répondu au traitement5.
L’aspect psychologique et le sentiment d’être soutenu émotionnellement sont également essentiels pour aider le patient à réduire le risque de développer une invalidité due à la rectocolite hémorragique. Ainsi, outre l’environnement du patient, les associations de patients, telles que celles de la Confédération ACCU en Espagne6 jouent un rôle décisif lorsque le patient doit faire face au diagnostic, aux traitements ou même au maintien d’une adhésion thérapeutique adéquate.
Dans ces groupes, les patients partagent leurs expériences avec des personnes qui se trouvent dans la même situation qu’eux ou qui l’ont déjà vécue. Des informations sont également apportées sur la maladie et les services de soins disponibles, et certains groupes organisent même des activités avec les patients et leurs proches.
- Que faire en cas de poussée de rectocolite hémorragique ? – Adacyte
- https://telecumple.educainflamatoria.com/calidad
- What is ulcerative colitis? – Adacyte
- Que signifie la rémission des patients atteints de maladies inflammatoires ? – Adacyte
- https://www.educainflamatoria.com/introduccion
- https://accuesp.com/
Contactez-nousPour en savoir plus
Contactez-nous